Archaebiotics - Archaebiotiques
voir les bases du concept archaebiotics ici
Des probiotiques de nouvelle génération
pour prévenir des pathologies graves
telles que l'athérosclérose ou la triméthylaminurie ?
Le microbiote intestinal et l'alimentation, une union qui peut être morbide...
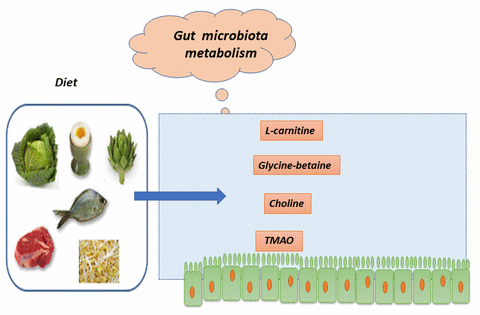
Depuis les travaux de Stan Hazen (Cleveland, Ohio, 2011), des composants de notre alimentation sont connus pour donner naissance, sous l'action de certaines bactéries du microbiote intestinal, à un composé retrouvé dans le sang et très délétère.
Ces composés / nutriments sont en particulier la phosphatidylcholine (ou lécithine) / la choline, la L-carnitine, le TMAO (ou oxyde de triméthylamine) ou la Glycyl-bétaïne.
La plupart de ces composés nous sont par ailleurs nécessaires / obligatoires en certaines quantité. Ils sont alors absorbés et utilisés par notre organisme.
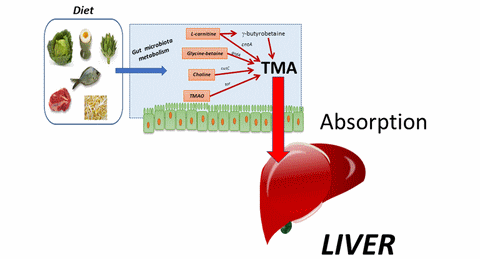
Cependant, une part d'entre eux peut être utilisée par certaines bactéries du microbiote intestinale, la plupart restant inconnue en 2016-2017. Certaines de ces bactéries possèdent en effet des enzymes capables de métaboliser ces composés (en absence d'O2 / en anaérobie).
Ceci aboutit à la formation de triméthylamine ou TMA, dans l'intestin. Cette TMA est absorbée par l'épithélium intestinal et va rejoindre le foie par la veine porte.
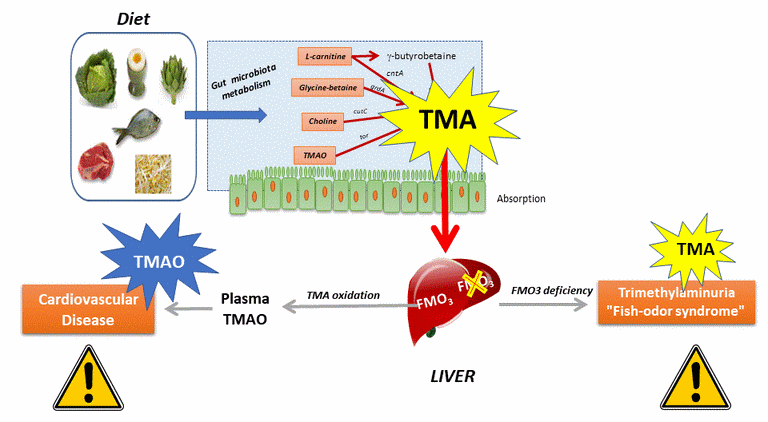
Dans le foie, cette molécule peut avoir deux destins différents selon qu'une enzyme hépatique, la Flavine Monoxygénase 3 ou FMO3, soit active / fonctionnelle ou non.
- Pour la majorité des personnes, cette enzyme est fonctionnelle (voie de gauche sur le schéma). La TMA d'origine intestinal subit alors une oxydation aboutissant à la formation d'oxyde de triméthylamine (ou TMAO). Or, Stan Hazen et collaborateurs ont révélé que cette molécule est un facteur de risque cardiovasculaire important, qui participe activement notamment à l'athérosclérose (Voir ici pour plus de détails en image).
- Pour quelques personnes, l'enzyme hépatique FMO3 n'est pas fonctionnelle ou est absente, pour des raisons génétiques (maladie rare, autosomale récessive, avec un taux d'hétérozygotes porteurs au Royaume Uni de 0.5 à 1% (voir ici). Dans ce cas alors, la TMA va circuler dans les différents fluides corporels de l'individu. Or, cette molécule est très volatile et surtout... très malodorante : c'est en effet elle qui confère au poisson pourri son odeur si caractéristique, à laquelle nous sommes extrêmement sensibles. Les personnes atteintes de cette pathologie présente donc une triméthylaminurie (présence de triméthylamine TMA, dans les urines) où elle est détectée pour en faire le diagnostic médical avéré. Encore appelée "syndrôme de l'odeur de poisson pourri" (Fish-odor syndrome en anglais), cette pathologie est psycho-socialement très invalidante.
Comment intervenir ?
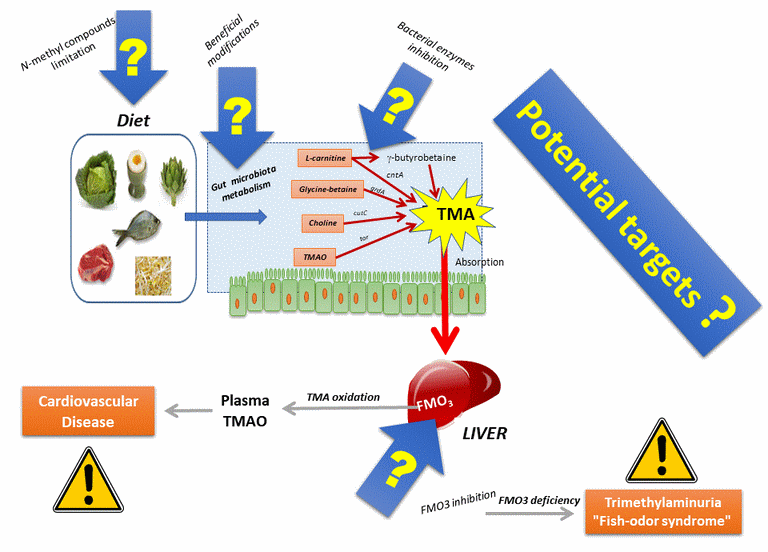
Les deux pathologies précédentes sont en définitive induites par la fabrication de triméthylamine TMA par le microbiote intestinal humain, à partir de plusieurs types de nutriments. Ceci rend une prévention difficile, car ces nutriments sont par ailleurs essentiels au bon fonctionnement de l'organisme, des carences pouvant provoquer des troubles très importants. En conséquence, intervenir sur l'alimentation pourrait être une piste possible, mais très délicate, car des aliments très différents apportent ces nutriments et il faut garantir un apport minimum de ces composés N-méthylés pour éviter des carences. Une autre approche consisterait à intervenir sur le microbiote intestinal humain, de manière à empécher la conversion de ces composés N-méthylés en TMA : Pour l'instant, les bactéries impliquées restent inconnues et des essais de probiotiques se sont avérés jusqu'à maintentant inefficaces. "Taper" de manière plus "violente" en utilisant des antibiotiques ne peut être considéré comme une solution applicable à long terme ou généralisable, même si elle est exceptionnellement parfois utilisée dans des cas de triméthylaminurie. Une piste prometteuse pourrait être l'utilisation d'inhibiteurs des enzymes bactériennes impliquées dans la synthèse de TMA. Elle pourrait néanmoins entrainer des modifications du microbiote intestinal, dans sa composition globale, dont les conséquences ne sont pas prévisibles, et il semble difficile d'avoir un seul inhibiteur pour les différentes enzymes impliquées. Néanmoins, appliqué de manière personnalisée, en fonction des bactéries de l'individu impliquées, ce sera peut-être une solution intéressante. Sur ce même registre, on pourrait imaginer un remplacement du microbiote responsable par un microbiote n'ayant pas ces activités enzymatiques bactériennes : réalisé par Transplantation de Microbiote Fécal (ou FMT) cette solution est très séduisante mais reste inexploitable rapidement et à grande échelle, tout en soulevant des questions éthiques et sanitaires. Enfin, on pourrait imaginer intervenir sur l'activité de l'enzyme hépatique humaine FMO3, celle responsable de la transformation de la TMA intestinale en TMAO circulante, pour prévenir les pathologies cardiaques ou les maladies rénales chroniques. Cependant, si elle s'avérait efficace, elle aboutirait à créer une triméthylaminurie / à dévclencher un syndrome de l'odeur de poisson pourri.
Une autre approche envisageable, des "probiotiques de nouvelle génération" avec un recours aux Archaea ?
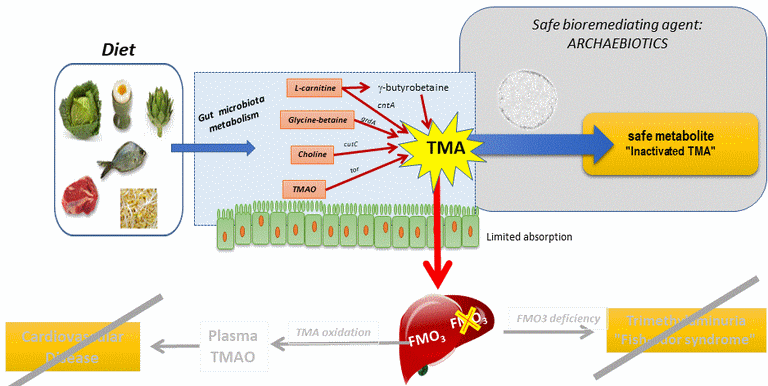
Une autre solution envisageable est d'intervenir après la formation de TMA par le microbiote intestinal, mais avant qu'elle soit absorbée et transformée par le foie en TMAO. Cela consiste en une remédiation de la TMA synthétisée en une molécule qui soit sans danger pour l'Homme. Cela nécessite par ailleurs des micro-organismes capables de vivre dans le microbiote intestinal humain, et capables de transformer cette molécule dans ce contexte d'anaérobie poussée (l'intestin humain).
Archaebiotics
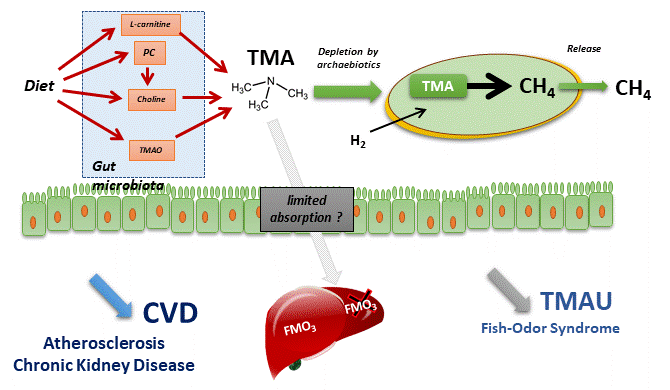
Or, ce type de métabolisme semble possible, par des micro-organismes non-bactériens et retrouvés naturellement dans le microbiote : certaines archées méthanogènes de l'ordre des Methanomassiliicoccales. Celles-ci peuvent transformer la TMA en méthane, un gaz considéré comme "inerte" pour la santé humaine. D'autres microorganismes en sont-ils capables ?
La réponse est difficile à apporter mais la reconnaissance de la triméthylamine TMA pour sa transformation enzymatique en anaérobie nécessite le recours à un acide aminé particulier, la Pyrrolysine. Cet acide aminé ("Pyl" en code international 3 lettres, "O" en code une lettre") est en fait le 22ème acide aminé codé par le code génétique, et est de découverte très récente (2002). Cependant, Pyl n'est présent que chez de très rares organismes, et très majoritairement des archées méthanogènes : les Methanosarcinales (absentes des microbiomes intestinaux humains) et les Methanomassiliicoccales (et encore, pas toutes).
Cette approche est décrite (en anglais) originellement dans l'article scientifique disponible ici , et d'une manière plus simple, dans le chapitre de livre consultable ici . Enfin, une description en est donnée dans le numéro 532 du magazine "La Recherche" de février 2018 (en français).
Une génétique et un métabolisme complexe sont nécessaires...
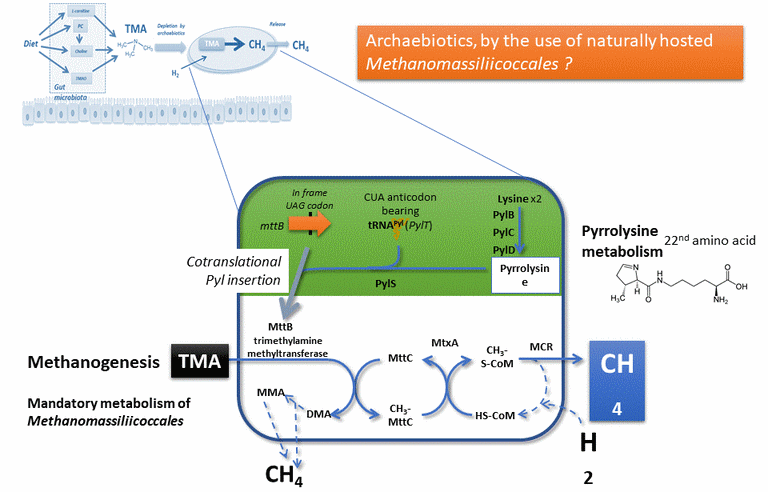
La nécessité de l'acide aminé Pyl / Pyrrolysine dans ce métabolisme rend le phénomène plus complexe. Il faut d'abord un organisme capable de fabriquer cet acide aminé, ce qui est réalisé par 3 enzymes à partir d'un acide aminé "traditionnel", la Lysine.
De manière très originale, ces organismes utilisent une modification du code génétique, en réattribuant au codon ambre (habituellement un codon "Stop") une fonction d'encodage, par un ARNt (ARN de transfert, encodé par le gène pylT dans le schéma ci-contre) assurant l' "orthogonalité du code génétique", c'est à dire la correspondance entre un codon (3 bases nucléiques) et un acide aminé. Ceci nécessite une enzyme capable de reconnaître à la fois le bon ARNt et y lier le bon acied aminé, la Pyl-tRNA amino-acyl transférase PylS.
Dans le cas du système Pyl des Methanomassiliicoccales, l'ARNt et l'enzyme liant Pyl à l'ARNt sont très originaux dans leurs structures.
Pour une description plus avancée du système Pyl (ci-contre, une modélisation 3D de la structure de l'ARNt-Pyl de, suppresseur du codon amber, chez Methanomethylophilus alvus), vous pouvez consulter quelques uns de nos articles scientifiques (en anglais), notamment celui-ci. Egalement, vous pouvez accéder à la page dédiée à la pyrrolysine sur ce site.
Une approche réellement concevable ?
- qu'il n'existe pas de pathogènes connus chez les archées (ni pour l'Homme, l'animal ou même les plantes !), ce qui rend l'idée prometteuse, tout en sachant que certaines Methanomassiliicoccales sont naturellement présentes dans le microbiote intestinal humain
- que ce métabolisme de méthanogenèse est un métabolisme obligatoire pour ces espèces, ne pouvant être réalisé qu'avec peu de substrats autres que la TMA : ceci permet d'envisager une efficacité dans la conversion de cetteTMA.